Новый инструмент для ЭКО может повысить эффективность процедуры
 1816
1816 1
1
Парам, безуспешно пытающимся зачать ребенка естественным путем, технология экстракорпорального оплодотворения (ЭКО) предлагает альтернативный способ. В ходе этой процедуры в лабораторных пробирках осуществляется оплодотворение яйцеклеток сперматозоидами, после чего из оплодотворенных ооцитов развиваются эмбрионы. Затем лучшие эмбрионы переносятся в матку пациентки и после успешной имплантации вынашиваются естественным образом до родов.
Метод ЭКО, нередко творящий чудеса для бездетных пар, принес в 2010 г. своему изобретателю Роберту Эдвардсу (Robert Edwards) Нобелевскую Премию. Однако процедура может быть длительной, затратной и эмоционально истощающей, порой требуя многих циклов для наступления успешной беременности. Согласно данным Американского Общества Репродуктивной Медицины (American Society for Reproductive Medicine), в среднем в США стоимость одного цикла может достигать 12 тыс. долларов, что делает процедуру недоступной для многих пар.
Для повышения доступности ЭКО группа исследователей из Национального Университета Цин Хуа (National Tsing Hua University, Тайвань) разработала технику более эффективного выращивания и скрининга эмбрионов на доимплантационном этапе. Их результаты, опубликованные в журнале Biomicrofluidics, могли бы способствовать более точному отбору эмбрионов для имплантации, что привело бы к росту результативности и, неизбежно, снижению стоимости.
«Стресс пациентов значительно снизится, если количество попыток и перенесенных эмбрионов будет уменьшено до поддержания надежного результата, – говорит Чичен Чен (Chihchen Chen), ведущий исследователь проекта, – Мы заинтересованы в понимании основных потребностей развивающегося эмбриона и намереваемся повысить уровень культивирования».
Нередко эмбрионы помещаются вместе в небольшую каплю среды для культивирования и переносятся в матку. Культивирование эмбрионов группой эффективно, но делает имплантацию менее избирательной: сотрудникам эмбриологической лаборатории не удается оценить жизнеспособность отдельного эмбриона в микрокапле.
Вместо этого тайваньские исследователи разработали способ культивирования эмбрионов в лабораторной чашке с открытыми микролунками и распределением эмбрионов таким образом, что в каждой лунке будет находиться один или два эмбриона. Слой масла сверху предотвращает передвижение эмбрионов между микрокаплями, при этом позволяя микропипетке проникать внутрь системы, чтобы в дальнейшем перенести эмбрионы в матку. Система микролунок дает каждому эмбриону собственное микроокружение, позволяя исследователям регулярно определять жизнеспособность каждого эмбриона.
«Эмбрионы очень чувствительны к своему окружению. Понимание микроокружения эмбрионов позволяет нам повысить их рост и минимизировать эпигенетические манипуляции над эмбрионами», – говорит Чен.
Чен и его коллеги использовали высокоразрешающую замедленную покадровую съемку, чтобы проследить индивидуальное развитие эмбрионов мышей. «Интересно, что эмбрионы успешнее развивались в бластоцисты (стадия, на которой происходит имплантация) в тех случаях, когда культивировались в крошечных микролунках», – отмечает Чен.
Более того, продолжительность времени, необходимая эмбрионам для достижения 4- и 8-клеточной стадии, четко предсказывает скорость их развития в бластоцисту, обеспечивая более простой способ наблюдения и выбора эмбрионов с наибольшим потенциалом имплантации на более ранних стадиях. Таргетный подход к имплантации мог бы снизить количество эмбрионов, необходимых для процедуры, сокращая, таким образом, время и стоимость.
Несмотря на то, что первоначальные эксперименты проведены на эмбрионах мышей, Чен и ее коллеги надеются, что однажды их работа обретет клиническую значимость. «После того, как экспериментальные условия будут оптимизированы для эмбрионов человека и пройдут клиническое подтверждение, метод можно будет применить в экстракорпоральном оплодотворении для человека», – говорит Чен.
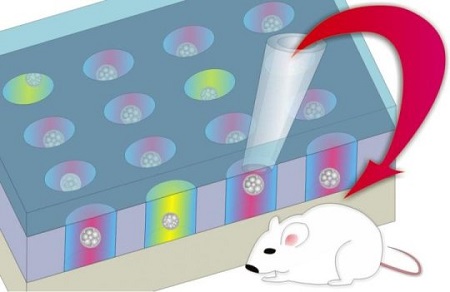
Культивирование эмбрионов в индивидуальных микролунках дает возможность выбора наиболее жизнеспособных эмбрионов для переноса. (фото: Chihchen Chen/National Tsing Hua University, the National Health Research Institutes in Taiwan)
По материалам American Institute of Physics (AIP)
Оригинальная статья:
Yu-Hsiang Chung, Yi-Hsing Hsiao, Wei-Lun Kao, Chia-Hsien Hsu, Da-Jeng Yao, and Chihchen Chen. Microwells support high-resolution time-lapse imaging and development of preimplanted mouse embryos. Biomicrofluidics, 2015 DOI: 10.1063/1.4918642






Одиночное культивирование эмбрионов в микрокаплях уже давно используется в большинстве западных клиник, технология тайм-лапс (замедленной съемки) тоже становится все популярнее, однако не способствует резкому росту беременностей и рождения детей в DHN/
Остается предполагать, что новшество исследователей заключается лишь в микро-объемах лунок со средой для культивирования (порядка 10 мкл). Но на мой взгляд, остается открытым вопрос относительно удобства манипулирования с такими объемами для операциониста (эмбриолога).
И, конечно, пока не понятно, будут ли результаты на эмбрионах человека столь же хороши.