На пути к персонализированной медицине
 1899
1899 0
0
Давно выяснено, что разные люди могут с разной эффективностью отвечать на терапию одним и тем же лекарственным средством. Для одного пациента препарат может оказаться абсолютно неэффективным, а у другого он может привести к возникновению серьезных побочных эффектов вплоть до летального исхода. Расшифровка генома человека 10 лет назад положила начало развитию персонализированной медицины, основным принципом которой является подбор методов лечения в соответствии с генетическими особенностями пациентов.
Человеческий геном состоит приблизительно из трех миллиардов пар оснований. Несмотря на то, что более 99% последовательности ДНК у всех людей одинаково, менее 1% пар нуклеотидов у разных людей может варьировать. «Эти различия представляют собой однонуклеотидные полиморфизмы (single nucleotide polymorphism, SNP). Считается, что в человеческом геноме содержится более 10 млн. однонуклеотидных полиморфизмов, определяющих индивидуальные особенности человека, в том числе чувствительность к некоторым препаратам и риск развития побочных эффектов, - объяснил Тайсей Муширода (Taisei Mushiroda), возглавляющий исследовательскую группу по фармакогеномике в Центре Геномной Медицины (Center for Genomic Medicine) при Институте физико-химических исследований (RIKEN, Япония).
Изучение генетических особенностей пациентов позволит индивидуализировано подойти к выбору лекарственного средства и тем самым свести к минимуму возникновение побочных эффектов от применения препарата. Научная группа Муширода достигла больших успехов в данной области, исследуя возможность индивидуального назначения лекарственных препаратов на основе анализа SNP пациентов.
По данным Министерства здравоохранения, труда и социального обеспечения Японии, наибольшее количество случаев аллергических реакций, проявляющихся в виде медикаментозной сыпи, было отмечено у пациентов при приеме таких препаратов как аллопуринол для лечения подагры, противоэпилептический препарат карбамазепин и противовоспалительный, жаропонижающий препарат локсопрофен.
«Согласно собранным нами данным, наибольшее число случаев возникновения медикаментозной сыпи обусловлено приемом карбамазепина. Прибегнув к методу полногеномного ассоциативного исследования (Genome-Wide Association Study, GWAS), мы решили выяснить, есть ли ассоциация между приемом карбамазепина и индивидуальными генетическими особенностями пациентов. Исследуемая выборка была разделена на две группы: пациенты, у которых возникли побочные эффекты при приеме лекарства, и пациенты, у которых медикаментозная терапия не вызвала аллергии. Мы провели комплексный анализ SNP в геноме пациентов, чтобы с помощью статистических методов выявить те, которые достоверно ассоциированы с возникновением медикаментозной сыпи. В результате нам удалось идентифицировать полиморфизм, связанный с возникновением сыпи – им оказался аллельный вариант *3101 гена HLA-A» – рассказал Муширода.
Исследование было проведено на японцах, страдающих эпилепсией и принимающих лекарственный препарат карбамазепин. Из 61 пациента с медикаментозной сыпью у 37 человек (приблизительно 61%) был обнаружен аллельный вариант HLA- A*3101. В то же время из 376 пациентов, не имевших аллергической реакции при приеме карбамазепина, у 329 человек (около 88%) вариант HLA-A*3101 не был обнаружен.
«Установлено, что приблизительно у 3% пациентов, проживающих в Японии, прием карбамазепина вызывает медикаментозную сыпь. Из них около 60% имеют аллельный вариант HLA-A*3101. Поэтому приблизительно двум процентам пациентов, страдающим эпилепсией, рекомендуется назначать другие противоэпилептические препараты. Таким образом, частота возникновения медикаментозной сыпи может быть снижена на 2%», - говорит Муширода. Ассоциативная взаимосвязь была выявлена только в 2010 г., и, прежде чем эти данные можно будет применять в клинической практике, должны быть получены дополнительные доказательства.
Персонализированная медицина найдет применение в клинической практике в течение 1-2 лет
Следующим этапом после выявления ассоциированных с медикаментозной сыпью однонуклеотидных полиморфизмов станет оценка возможности применения метода в клинической практике. Также необходимо установить, действительно ли выявление SNP является терапевтически эффективным и экономически выгодным методом диагностики. В проводимом в настоящее время проспективном клиническом исследовании невирапина было подсчитано, что диагностика с использованием SNP сократит ежегодные медицинские расходы каждой больницы приблизительно на 60 тыс. долларов США (около 5 млн. йен). Этот этап исследования необходим для успешного применения новой системы в отношении противоэпилептического препарата карбамазепина.
Перед началом активного применения генотипирования однонуклеотидных полиморфизмов в медицинской практике необходимо разработать быстрый и точный метод их детекции по самой низкой стоимости. Команда ученых под руководством Муширода при сотрудничестве с компанией Toppan Printing Co. Ltd. и RIKEN Genesis Co. Ltd. разработала систему анализа генотипов TPSA-003, способную более экономично генотипировать SNP. Для проведения анализа необходимо поместить одну каплю крови в специальный контейнер и поместить образец в прибор, после чего в течение часа система автоматически сообщит результаты исследования.
«Разработанная система является новаторским изобретением. Традиционный метод секвенирования подразумевает сложный процесс выделения лейкоцитов из образца крови, выделения ДНК из лейкоцитов и внесение ДНК в прибор для анализа SNP. В обычных условиях только выделение ДНК занимает практически половину дня, даже если осуществляется высококвалифицированным специалистом. Применение новой системы для этой же цели, включая генотипирование SNP, позволяет провести анализ всего за 60 минут. Это означает, что точный диагноз может быть поставлен за то время, пока пациент находится в комнате ожидания. Быстрая диагностика является большим преимуществом и для пациентов», - говорит Муширода.
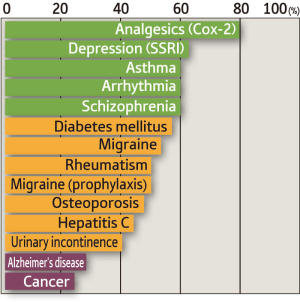
Эффективность лекарственных средств при различных заболеваниях. Некоторые препараты, например, анальгетики, одинаково эффективны при назначении практически всем пациентам, в то время как другие лекарства, например, противораковые препараты, эффективны при лечении только 25% больных. Двигаясь в сторону персонализированной медицины, важно разработать пути применения генетической информации при назначении пациентам наиболее подходящих лекарственных препаратов с точки зрения их генетического риска к развитию побочных эффектов. (фото: Copyright : RIKEN)
По материалам RIKEN





