Как поймать и обезвредить вирус
 2138
2138 0
0
Свойства белка определяются его пространственной структурой и биохимическими особенностями. Синтез белковой молекулы начинается с построения линейной аминокислотной цепи (так называемая первичная структура белка), из которой в процессе фолдинга формируется определенная трехмерная (вторичная и третичная) структура. Ученые из Центра Молекулярной Медицины имени Макса Дельбрюка решили более подробно изучить трехмерную структуру белка MxA, чтобы выяснить, каким образом он связывается с вирусной частицей и осуществляет ее изоляцию.
Известно, что один из участков белка MxA имеет форму стержня, к которому присоединяется еще 4 субъединицы, образуя единый комплекс. Такие кластеры, состоящие из 4 субъединиц и «стержня», необходимы для связывания с вирусной частицей и сборки особой кольцевидной структуры, служащей для изоляции вируса. После того, как ученые сконструировали мутантную форму белка MxA с небольшими изменениями в «стержне» - участке белка, без которого сборка кольцевидной структуры невозможна, MxA утратил способность изолировать вирусные частицы.
Поскольку белки обладают малым размером, и их невозможно рассмотреть даже в самый мощный микроскоп, для выявления молекулярной структуры белка MxA ученые прибегли к методу рентгеновской кристаллографии. Метод основан на кристаллизации белка и последующем направлении на него рентгеновских лучей, по дифракции которых можно судить о его трехмерной структуре.
Получив трехмерное изображение «стержня», ученые обнаружили, что цепочка аминокислот в этом участке белка формирует длинные спирали, упакованные в структуру наподобие связки. Такой комплекс имеет три поверхности, к которым могут прикрепляться аналогичные структуры других молекул белка MxA. В результате такой сборки на одном конце белкового комплекса формируется область связывания с вирусными частицами, а другой конец остается подвижным (т.н. моторный конец) и работает за счет энергетических молекул ГТФ. Энергия затрачивается на связывание вирусных частиц.
Некоторые мутации в гене MxA приводят к изменению его активности, другие – нет. В результате исследования выяснилось, что, если генетические изменения в белке затрагивают «стержень», то белок теряет способность формировать кластеры, а также связываться с вирусными частицами.
Новые данные о белке MxA позволят ученым лучше изучить и другие белки, имеющие структуры типа стержня. Например, белок динамин, также использующий энергию молекул ГТФ, играет важную роль в процессах везикулярного транспорта. Многие белки, полисахариды и другие макромолекулы не способны напрямую пройти сквозь клеточные мембраны, поэтому их транспорт осуществляется посредством везикулярного переноса. Это означает, что в другую клетку или же из одного мембранного компартмента клетки в другой макромолекулы попадают заключенными в специальные пузырьки (везикулы).
Белок динамин, в частности, играет важную роль в передаче нервного импульса между нейронами, и мутации в его гене ассоциированы с различными нервными и мышечными заболеваниями. Сильное сходство участков типа «стержня» динамина и белка MxA позволило сделать некоторые выводы о функционировании динамина. Выяснилось, что именно благодаря сборке больших мультимолекулярных динаминовых комплексов, которая происходит с помощью «стержня», активируются моторные механизмы динамина (за счет энергии ГТФ), позволяющие везикулам отпочковываться от мембраны. Теперь ученые смогут использовать энергию ГТФ для искусственной активации моторных механизмов динамина и повышения активности везикулярного транспорта.
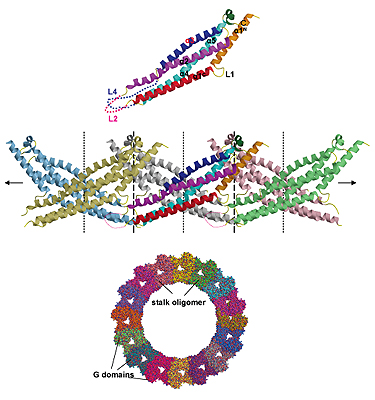
Структура в виде стержня белковой молекулы MxA (наверху). Этот участок соединяется с аналогичными структурами других молекул MxA. В нижней части схемы изображена кольцевидная структура, сформированная 32 молекулами белка MxA, соединенными друг с другом с помощью «стержней». Внутрь такой структуры помещается захваченный вирус, а внешняя ее сторона является моторной и работает за счет энергии ГТФ.
По материалам:
Maw Delbrueck Centrum fuer Moleculare Medizin
Оригинальная статья:
Gao S, von der Malsburg A, Paeschke S, Behlke J, Haller O, Kochs G, Daumke O. Structural basis of oligomerization in the stalk region of dynamin-like MxA. Nature. 2010 May 27; 465(7297):502-6.





