Ученые продемонстрировали эффективность нового способа лечения спинальной мышечной атрофии
 6131
6131 0
0
Исследовательская команда из Лаборатории Cold Spring Harbor (Cold Spring Harbor Laboratory, CSHL, США) получила новые сведения о причинах развития патологических изменений при спинальной мышечной атрофии (СМА) – группе редких наследственных заболеваний, характеризующихся тяжелым течением, мышечной слабостью и параличом конечностей, и являющихся основной генетической причиной гибели новорожденных детей. Новые данные могут помочь в разработке возможных методов лечения пациентов с СМА.
СМА – группа заболеваний, приводящих к дегенерации моторных (двигательных) нейронов, контролирующих мускулатуру и сознательные движения человека. Для работы этих нейронов необходим белок SMN (Survival of Motor Neuron, белок, способствующий выживанию моторных нейронов). В норме все клетки могут синтезировать два варианта белка SMN – SMN1 и SMN2. У здоровых людей белок SMN1 вырабатывается в больших количествах, в то время как белок SMN2 синтезируется преимущественно в укороченной нестабильной форме из-за молекулярного редактирования.
У пациентов с СМА синтез белка SMN1 нарушен, в результате чего клетки вынуждены использовать малое количество белка SMN2 полноценной длины, синтезируемое одновременно с короткими нефункционирующими вариантами белка.
Профессор Адриан Крейнер (Adrian Krainer) из CSHL совместно с фармакологической компанией Isis Pharmaceuticals разработал лекарственный препарат, позволяющий скорректировать редактирование синтезированного белка SMN2, увеличив, таким образом, его количество в нейронах. Результаты применения лекарственного препарата, названного ASO (antisense oligonucleotide), на доклинической модели СМА на мышах продемонстрировали его перспективность в качестве средства терапии этого заболевания. Препарат представляет собой короткий одноцепочечный фрагмент из аналогов дезоксирибонуклеотидов, который связывает комплементарную ему мРНК синтезированного белка. В настоящее время препарат проходит III фазу клинических испытаний на пациентах с СМА.
Лекарственный препарат ASO вводят непосредственно в спинномозговую жидкость детей и новорожденных с СМА. «Специалисты считают, что белок SMN необходим для работы центральной нервной системы (ЦНС), но не нужен для функционирования, например, в конечностях и печени, поэтому все усилия были направлены на увеличение концентрации белка SMN полноценной длины в ЦНС, – говорит Крейнер. – За последние несколько лет возросло число сведений, усложняющих наши представления о патологии СМА. Вопрос звучит так: нужно увеличивать концентрацию белка SMN в ЦНС, или в периферических тканях, или одновременно в этих двух областях?»
В новом исследовании, результаты которого были опубликованы в журнале Genes & Development, ученые разработали метод восстановления синтеза белка SMN только в периферических тканях, что позволило им определить роль лекарственного препарата как в ЦНС, так и за ее пределами. Научная группа подкожно вводила лекарственный препарат ASO мышам с моделью СМА. В соответствии с результатами предыдущих исследований, препарат повысил концентрации белка SMN в ЦНС и периферических тканях, поскольку у новорожденных мышей (но не у взрослых особей) небольшое количество препарата, введенного на периферии, может попасть и в ЦНС. Проведенное лечение излечило животных от заболевания.
Полученные результаты важны для разработки оптимальных стратегий лечения пациентов с СМА. «Лекарственный препарат ASO уже продемонстрировал большой потенциал в клинической практике. Существует вероятность того, что модифицирование способа введения лекарственного препарата в организм пациента может привести к улучшению клинических результатов лечения. Альтернативно, полученные нами данные могут отражать уникальные специфические особенности модели заболевания на мышах, но даже в этом случае будет важно понять механизмы, лежащие в основе развития заболевания», – говорит Крайнер.
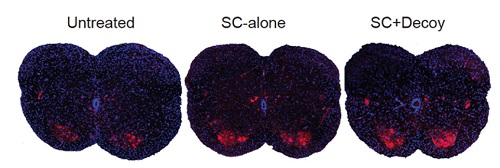
Исследователи из CSHL на модели СМА на мышах продемонстрировали, что лекарственный препарат для лечения этого заболевания эффективен даже при подкожном введении, то есть его не обязательно вводить в ЦНС. На рисунке изображены срезы спинного мозга, полученные от трех разных мышей с СМА. Системная терапия (в ЦНС и периферийно) лекарственным препаратом (изображение посередине) увеличивает количество моторных нейронов (красные точки), по сравнению с мышами, которым лечение не проводилось (изображение слева). При проведении лечения, избегающего попадание лекарства в ЦНС животного (изображение справа), были получены схожие результаты, что свидетельствует в пользу возможного нового способа лекарственной терапии пациентов с СМА. (фото: Image courtesy of Cold Spring Harbor Laboratory)
По материалам Cold Spring Harbor Laboratory
Оригинальная статья:
Yimin Hua, Ying Hsiu Liu, Kentaro Sahashi, Frank Rigo, C. Frank Bennett, and Adrian R. Krainer. Motor neuron cell-nonautonomous rescue of spinal muscular atrophy phenotypes in mild and severe transgenic mouse models. Genes & Development, January 2015 DOI: 10.1101/gad.256644.114





