Тестируется препарат, вызывающий апоптоз раковых клеток
 4062
4062 0
0
Ученые-онкологи обнаружили молекулу, способную активировать работу собственной защитной системы организма и запустить программу уничтожения раковых клеток. Результаты экспериментов на мышах c трудноизлечимой формой рака головного мозга показали, что введение молекулы в организм не влияет на состояние здоровых тканей. Результаты исследования были опубликованы в журнале Science Translational Medicine [1].
Молекула TIC10 активирует ген белка TRAIL (tumour-necrosis-factor-related apoptosis-inducing ligand). В течение долгого времени этот белок был объектом исследований ученых-онкологов, разрабатывающих новые лекарственные препараты, которые обладали бы большей эффективностью, по сравнению с традиционными методами лечения онкологических больных.
По словам руководителя исследования Вафика Эль-Дейри (Wafik El-Deiry), онколога из Университета штата Пенсильвании (Pennsylvania State University, США), белок TRAIL является частью иммунной системы человека, препятствующей образованию и распространению опухолей в организме человека. Именно поэтому усиление активности белка TRAIL не будет оказывать таких токсичных эффектов на организм, как химиотерапия.
Результаты экспериментов показали, что молекула TIC10 обладает мощным противоопухолевым действием. Она способна уничтожать злокачественные клетки различных типов, включая клетки рака молочной железы, толстой кишки, легкого и лимфатической системы. Наиболее выраженное действие молекулы TIC10 наблюдалось при индуцировании апоптоза клеток глиобластомы, разновидности опухоли головного мозга, трудно поддающейся лечению традиционными методами [2]. Мыши с глиобластомой из экспериментальной группы получали курс лечения, в который входило сочетанное применение молекулы TIC10 и бевацизумаба. Бевацизумаб – лекарственный препарат, продаваемый под коммерческим названием Авастин и используемый, в том числе, для лечения пациентов с опухолями головного мозга. Результаты исследования показали, что выживаемость животных из экспериментальной группы была в три раза выше, чем в контрольной группе, в которой лечение не проводилось. Выживаемость мышей, которых лечили только молекулой TIC-10, была на 6% выше, чем выживаемость мышей, получавших монотерапию бевацизумабом.
По мнению Эль-Дейри, высокая эффективность применения молекулы TIC10 обусловлена тем, что молекула имеет намного меньшие размеры, чем ранее протестированные препараты, активирующие белок TRAIL. Маленькие размеры молекулы позволяют ей проникать через гематоэнцефалический барьер, отделяющий кровеносную систему организма от тканей головного мозга. В норме гематоэнцефалический барьер препятствует проникновению в головной мозг опасных для здоровья агентов, например, микроорганизмов, способных вызвать воспаление. По этой же причине противоопухолевые лекарственные препараты тоже не могут в него проникнуть. «Мы не предполагали, что молекулу TIC10 можно будет использовать для лечения пациентов с опухолями головного мозга», - говорит Эль-Дейри.
Результаты исследований показали, что молекула TIC10 активирует ген TRAIL не только в раковых, но и в здоровых клетках. При этом возникает так называемый «эффект наблюдателя», когда апоптоз индуцируется в раковых клетках, расположенных в непосредственной близости от здоровых клеток, на поверхности которых также увеличивается количество рецепторов к белку TRAIL. Рецепторы здоровых клеток связываются с раковыми клетками, вызывая их гибель.
Но это отнюдь не единственный механизм, запускающий гибель раковых клеток. Например, ученые-онкологи разрабатывают несколько лекарственных препаратов, механизм действия которых заключается в активации ракового белка p53. По словам Эль-Дейри, терапевтические подходы, основанные на использовании белка p53, не во всех случаях являются эффективными, поскольку в большинстве типов раковых клеток нарушено функционирование этого белка. Подход, разработанный исследовательской командой под руководством Эль-Дейри, позволяет «обойти» проблемы, связанные с белком p53.
Несмотря на то, что исследование проводилось только на мышах, научная группа уверена, что применение аналогичной стратегии у людей тоже будет эффективным.
Перспективы применения активаторов белка TRAIL в качестве противоопухолевых средств нового поколения были впервые озвучены в середине 1990-х гг. [3]. По словам Эндрю Торборна (Andrew Thorburn) из Университета Колорадо (University of Colorado, США), соавтора обзорной статьи, посвященной этой проблеме, опубликованной в прошлом году [4], несмотря на то, что результаты первых клинических испытаний продемонстрировали низкую токсичность терапии, основанной на активации белка TRAIL, ее применение с целью лечения пациентов с онкологическими заболеваниями оказалось мало эффективным. «Ни одно клиническое испытание не продемонстрировало роста выживаемости пациентов при совместном применении стандартного лечения и TRAIL-терапии», - говорит Торборн. Многие исследовательские группы отложили проведение крупных биомедицинских испытаний лекарственных препаратов, активирующих белок TRAIL.
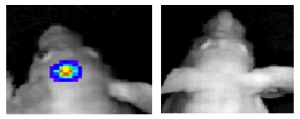
Мыши с опухолью головного мозга, которых лечили новым лекарственным препаратом, проявляют признаки выздоровления (справа), по сравнению с мышами, которым лечение не проводили (слева, опухоль окрашена разными цветами).
По материалам NatureNews
Оригинальная статья:
Nature doi:10.1038/nature.2013.12385
Литература:
1. Allen, J. E. et al. Sci. Transl. Med. 5, 171ra17 (2013).
2. Menon, L. G. et al. Stem Cells 27, 2320–2330 (2009).
3. Wiley, S. R. et al. Immunity 3, 673–682 (1995).
4. Dimberg, L. Y. et al. Oncogene http://dx.doi.org/10.1038/onc.2012.164 (2012).





