Стволовые клетки не нужны для обновления тканей?
 3549
3549 0
0
Исследователи и клиницисты считают, что медицина будущего будет основана на замещении поврежденных и погибших клеток организма стволовыми клетками. Стволовые клетки способны не только практически неограниченно делиться, но и давать начало ряду специализированных клеток в организме. Тем не менее, дифференцировка различных типов стволовых клеток – сложный процесс, в ходе которого могут происходить различные нежелательные явления – например, злокачественная трансформация. По этой причине возможность применения в клеточной терапии не стволовых, а уже специализированных клеток кажется весьма привлекательной.
Обычно клетки, достигнув терминальной стадии дифференцировки, перестают делиться и функционируют в течение определенного времени, после чего гибнут. Это справедливо для клеток нервной, мышечной и других тканей. Макрофаги (1), являющиеся ключевыми клетками в реализации иммунных реакций, также не способны к пролиферации, достигнув конечной стадии дифференцировки. Однако французским исследователям удалось «заставить» макрофаги мышей делиться, заблокировав в них с помощью генетических модификаций активность транскрипционных факторов MafB и c-Maf (2). После обратного введения в организм животного такие генномодифицированные макрофаги вели себя нормально: они не давали начала злокачественным опухолям и прекрасно справлялись с функциями обычных макрофагов – например, с поглощением бактерий и с секрецией специфических биологически активных факторов.
Оказалось, что инактивация факторов MafB и cMaf приводит к активации четырех других транскрипционных факторов, в частности, c-Myc и Klf4, которые могут вернуть взрослую клетку в состояние, близкое к «стволовому». Возможно, подход, использованный в этой работе, будет применен не только в фундаментальных исследованиях дифференцировки клеток, но и в клинической практике для получения необходимых количеств специализированных клеток, способных восстановить функции поврежденных органов и тканей.
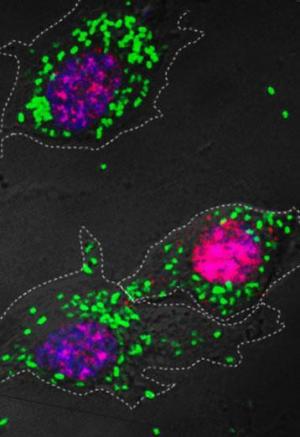
Бактерии (покрашены зеленым флуоресцентным красителем), «поедаемые» делящимися макрофагами.
Примечания:
(1) Макрофаги – крупные клетки, ответственные за уничтожение «клеточного мусора» и микроорганизмов, попавших в организм, в процессе фагоцитоза – «поедания» чужеродных микрообъектов.
(2) Транскрипционные факторы – белки, регулирующие экспрессию генов (подавляющие либо активирующие ее). В частности, они определяют ход дифференцировки клеток в процессе эмбрионального развития и во взрослом организме.
Оригинальная статья: Aziz et al. MafB/c-Maf Deficiency Enables Self-Renewal of Differentiated Functional Macrophages. Science, 2009; 326 (5954): 867 DOI: 10.1126/science.1176056