Новые данные о клеточном сигналлинге
 1584
1584 0
0
Рецепторы, сопряженные с G-белками (G protein-coupled receptors, GPCRs), составляют большое семейство трансмембранных рецепторов и выполняют функцию активаторов внутриклеточных путей передачи сигнала, приводящих в итоге к клеточному ответу (делению клетки, миграции и проч. в зависимости от связавшегося с рецептором лиганда). Лиганды, которые связываются с этими рецепторами и активируют их, включают гормоны, нейромедиаторы, светочувствительные вещества и феромоны.
Бета-2-адренергический рецептор активируется гормонами адреналином и норадреналином и запускает клеточные сигнальные пути, осуществляющие регуляцию работы сердца и легких. По словам Брайана Кобилка (Brian Kobilka), руководителя научной группы Стэндфордского Университета, изучение этих рецепторов крайне важно, так как они представляют собой ключевую мишень для множества препаратов. Поскольку GPCRs являются мишенями для 40-50% всех лекарственных препаратов на мировом рынке, снимок b2AR, связанного с G-белком, полученный методом рентгеновской кристаллографии, сможет помочь в разработке эффективной терапии множества заболеваний.
Метод рентгеновской кристаллографии основан на кристаллизации молекулы и последующем направлении на нее рентгеновских лучей, по дифракции которых можно судить о расположении атомов в узлах кристаллической решетки. Известно, что осуществить кристаллизацию GPCRs довольно сложно, так как для этого рецептор необходимо извлечь из клеточной мембраны и зафиксировать в липидной среде. В 2000 г. была определена структура светочувствительного GPCR – родопсина [2], однако GPCRs, активируемые гормонами и нейромедиаторами, оставались неизученными. Первым из лиганд-активируемых GPCRs, подвергнувшихся кристаллизации, стал b2AR, который не раскрывал своих структурных секретов вплоть до 2007 г., несмотря на многолетние попытки научной группы Кобилка и других ученых [3, 4, 5]. В течение последующих нескольких лет была определена кристаллографическая структура еще 4 GPCRs [6, 7, 8, 9].
Но изучение того, как GPCRs передают сигнал, требовало кристаллизации рецептора в комплексе с G-белком, что представляло собой еще более сложную задачу. G-белок состоит из 3 субъединиц и способен отсоединяться от рецептора. Получение структуры комплекса рецептора с G-белком потребовало разработки новой методики очистки и стабилизации этого комплекса, включая связывание его с антителами, а также тестирование множества различных условий кристаллизации.
«Это действительно прорыв, - говорит Стефан Спрэнг (Stephen Sprang), биохимик из Университета Монтаны (University of Montana, США), - Много лет ученые стремились изучить структуру этого комплекса, чтобы понять, как на самом деле работают рецепторы, сопряженные с G-белками».
Кржиштоф Палчевски (Krzysztof Palczewski), ученый из Западного Резервного Университета Кейса (Case Western Reserve University, США), впервые кристаллизовавший родопсин, признает огромный научный потенциал исследования. Однако он обеспокоен тем, что разработанные и используемые в исследовании Кобилка антитела могут не идеально подходить для естественных комплексов, встречающихся в природе. Однако, по словам Кобилка, его функциональные тесты показывают, что разработанные белки ведут себя так же, как и природные белки.
Известно, что инактивированные G-белки связаны с молекулой гуанозиндифосфата (ГДФ). Когда GPCR получает сигнал от лиганда, рецептор стимулирует отсоединение G-белка от ГДФ и способствует присоединению к нему молекулы гуанозинтрифосфата (ГТФ), что приводит к активации белка.
Выявленная структура комплекса рецептора с G-белком позволяет понять, как именно рецептор меняет свою пространственную организацию (конформацию) в данном процессе. Рентгеновская кристаллография предоставляет нам статичное изображение, так что точная последовательность событий остается неизвестной.
Данное открытие позволит изучить молекулярные механизмы действия холерного токсина, который активирует GPCRs-опосредованные сигнальные пути в клетках кишечного эпителия, приводя к чрезмерному высвобождению воды из клеток, что вызывает диарею и рвоту. «Область молекулы, модифицируемая холерным токсином, находится глубоко внутри G-белка, - говорит Роджер Сунахара (Roger Sunahara), руководитель научной группы Университета Мичигана, - Как токсин туда пробирается? Результаты нашего исследования показали, что субъединицы G-белка «разворачиваются», открывая область связывания с токсином. Если токсин таким образом работает, возможно, другие вещества взаимодействуют с G-белком точно так же».
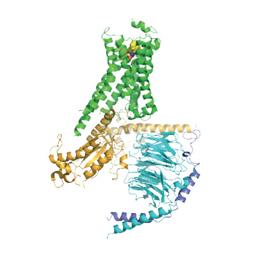
На изображении рецептор, сопряженный с G-белком. Кристаллографическая структура демонстрирует, как активация рецептора (помечен на рисунке зеленым цветом) небольшой сигнальной молекулой вызывает серьезные структурные изменения в связанном с ним G-белке (помечен на рисунке желтым, голубым и фиолетовым цветами).
По материалам:
NatureNews
Литература:
1. Rasmussen, S. G. F. et al. Nature http://dx.doi.org/10.1038/nature10361 (2011)
2. Palczewski, K. et al. Science 289, 739-745 (2000)
3. Rasmussen, S. G. F. et al. Nature 450, 383-387 (2007)
4. Rosenbaum, D. M. et al. Science 318, 1266-1273 (2007)
5. Cherezov, V. et al. Science 318, 1258-1265 (2007)
6. Shimamura, T. et al. Nature 475, 65-70 (2011)
7. Xu, F. et al. Science 332, 322-327 (2011)
8. Wu, B. et al. Science 330, 1066-1071 (2010)
9. Chien, E. Y. et al. Science 330, 1091-1095 (2010)





