Обнаружен молекулярный путь сигналинга, ответственный за развитие диабета II типа
 3473
3473 0
0
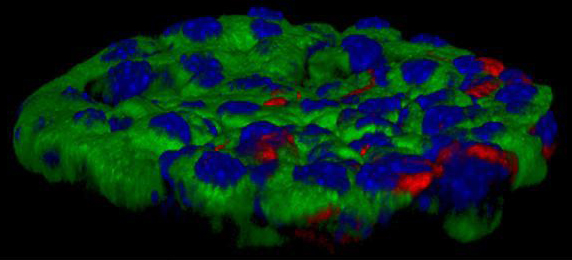
3-D микрофотография островка Лангерганса, изолированного из поджелудочной железы мыши. Основная масса клеток, помеченных зеленым цветом, ответственна за продукцию инсулина. Ядра клеток покрашены синим.
Диабет II типа – метаболическое расстройство, от которого страдают около 246 миллионов человек во всем мире. Профессор Вильгельм Крек (Wilhelm Krek) из Института Клеточной Биологии в Цюрихе (Institute of Cell Biology of ETH Zurich) и его коллеги обнаружили один из молекулярных механизмов, который может оказаться ключевым в развитии заболевания. В работе было показано, что сигнальный путь, контролирующий синтез инсулина, находится под контролем белковых продуктов генов pVHL и HIF1a, которые хорошо известны исследователям онкологических заболеваний как белки, участвующие в росте клеток и их энергетическом обмене. Эти данные не только расширяют знания о диабете, но указывают на возможность профилактики и лечения этого заболевания.
Вильгельм Крек объяснил, что клеткам для осуществления их метаболических функций требует энергия, которая запасается в виде молекулы с высокоэнергетичными связями – аденозин-трифосфорной кислоты (АТФ). У здорового человека бета-клетки поджелудочной железы, продуцирующие инсулин, реагируют на поступление в организм пищи. Глюкоза разрушается в митохондриях бета-клеток в процессе, называемом оксидативным фосфорилированием, после чего происходит синтез АТФ, которая, в свою очередь, запускает секрецию инсулина. Это стимулирует мышечные клетки поглощать глюкозу, нормализуя ее уровень в крови. Видимо, часть случаев развития диабета возникает в связи с нарушением этого механизма.
Изучая гены pVHL и HIF1a с помощью генетических модификаций, ученым удалось получить четыре линии мышей с разными комбинациями генов: тех, к которых оба гена функционировали нормально, две линии, в которых был активен только один из генов, и одну, у которой были инактивированы оба гена.
В нормальных условиях с достаточным доступом кислорода продукт гена HIF1a постоянно подавляется продуктом гена pVHL. Однако в условиях недостатка кислорода в митохондриях не синтезируется АТФ, что служит сигналом к активации гена HIF1a, который ответственен за продукцию АТФ посредством процесса гликолизиса – независимо от митохондрий.
Даже при нормальной продукции АТФ у животных с делецией гена pVHL был существенно изменен профиль продукции инсулина. При нормальном уровне глюкозы все происходило, как у животных с двумя активными генами, однако не наблюдалось увеличения продукции инсулина в ответ на поступление в организм большого количества глюкозы. Это доказывает, что продукция АТФ в митохондриях активирует несколько факторов – на данный момент неизвестных, – которые задействованы в секреции инсулина. При этом самой по себе продукции АТФ для синтеза инсулина недостаточно.
У мышей с ожирением количество бета-клеток резко увеличивается. Это приводит к нарушению кровоснабжения отдельных бета-клеток и, как следствие, к их кислородному голоданию. Крек и его коллеги предположили, что дефицит кислорода вызывает активацию подавленного гена HIF1a, который позволяет клеткам в этих условиях по крайней мере выжить. В результате этого эффективная и регулируемая секреция инсулина нарушается, его концентрация возрастает, но перестает зависеть от стимуляции глюкозой – это возможное начало диабета II типа. Заболевание развивается, когда бета-клетки начинают гибнуть в результате постоянно повышенной активности.
Таким образом, было показано, что pVHL и HIF1a играют важную роль в секреции инсулина и являются решающими в процессе синтеза АТФ. Следующим шагом будет использование этого знания в терапии диабета. Если бы был найден способ инактивации сигнального пути, запускаемого продуктом гена HIF1a у пациентов, страдающих от диабета, то стало бы возможно по крайней мере задержать развитие болезни на многие годы. Это ученые показали в экспериментах на мышах с диабетом, которые при подавлении белка HIF1a возвращались к хорошему состоянию здоровья, а митохондрии в их бета-клетках – к нормальному синтезу АТФ.
Оригинальная статья: Zehetner J, Danzer C, Collins S, Eckhardt K, Gerber PA, Ballschmieter P, Galvanovskis J, Shimomura K, Ashcroft FM, Thorens B, Rorsman P & Krek W. pVHL is a regulator of glucose metabolism and insulin secretion in pancreatic B2 cells. Genes & Development, 22, 3135-3146 DOI: 10.1101/gad.496908
По материалам:
ETH Zurich





